適正使用情報
投与前の確認事項
患者選択のフローチャート
アムヴトラの投与にあたり次の項目をご確認の上、適正な患者選択を行い、投与の可否を検討いただきますようお願いいたします。
適応となる患者
-
4.
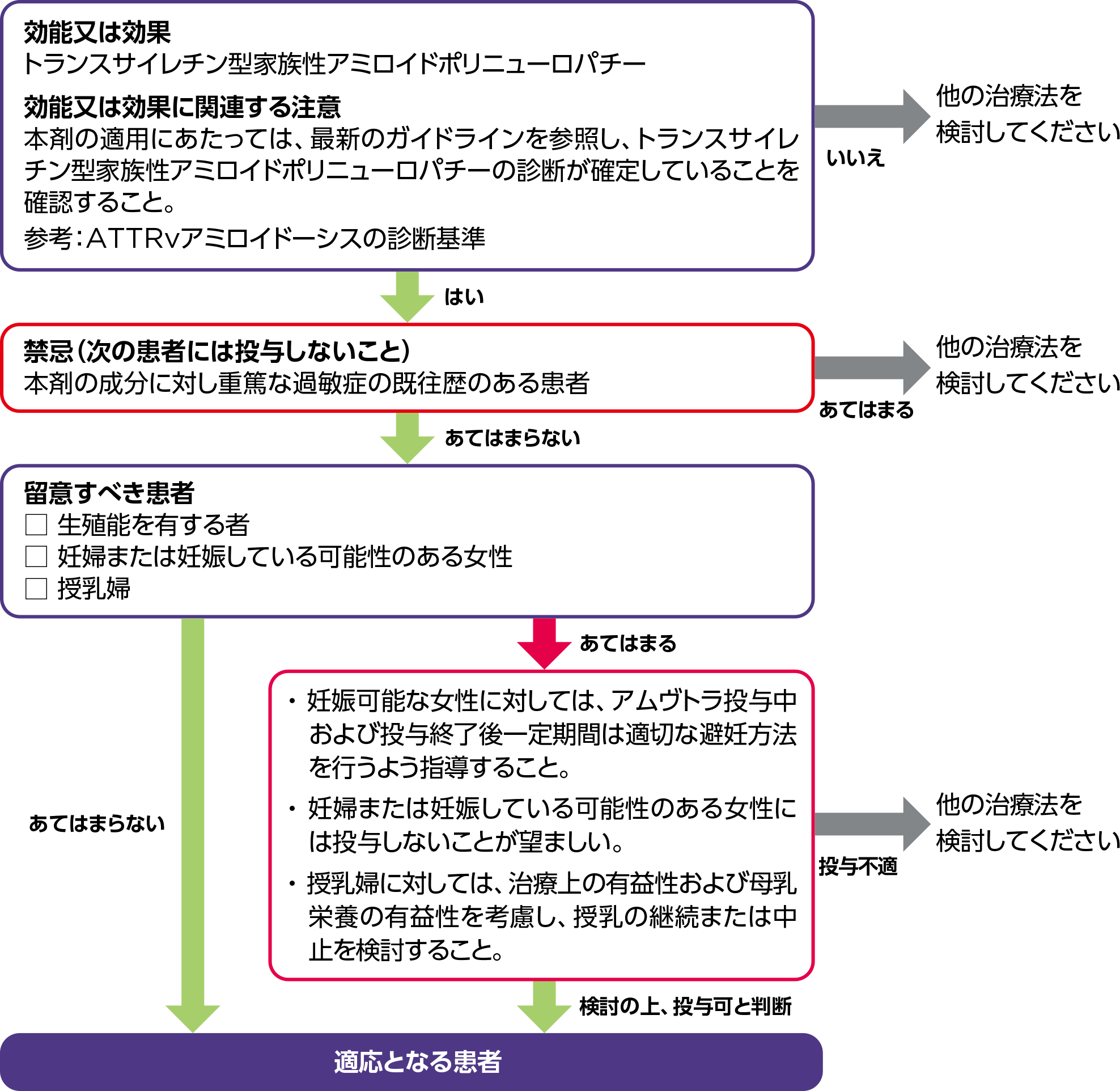
効能又は効果
〇トランスサイレチン型家族性アミロイドポリニューロパチー
〇トランスサイレチン型心アミロイドーシス(野生型及び変異型)
-
5.
効能又は効果に関連する注意
〈効能共通〉
-
5.1
本剤の適用にあたっては、最新のガイドライン等を参照し、トランスサイレチンアミロイドーシスの診断が確定していることを確認すること。
〈トランスサイレチン型心アミロイドーシス〉
-
5.2
本剤は、トランスサイレチン型心アミロイドーシスによる心不全を有する患者に使用すること。また、「臨床成績」の項の内容を熟知し、臨床試験の選択基準等を十分理解した上で、適応患者の選択を行うこと。[17.1.2参照]
-
5.3
NYHA心機能分類Ⅳ度の患者における有効性及び安全性は確立していない。
-
アムヴトラの電子化された添付文書より
-
- 診断基準
-
トランスサイレチンアミロイドーシスの診断基準については、厚生労働科学研究費補助金 難治性疾患政策研究事業 アミロイドーシスに関する調査研究班が作成した「ATTRvアミロイドーシス」の診断基準 http://amyloidosis-research-committee.jp/wp-content/uploads/2020/07/diagnostic_200702.pdf(2025年4月閲覧)を参照してください。
アムヴトラの効能又は効果は、「トランスサイレチン型家族性アミロイドポリニューロパチー」および「トランスサイレチン型心アミロイドーシス(野生型及び変異型)」です。本剤の適用にあたっては、トランスサイレチンアミロイドーシスの診断が確定していることを確認してください。
なお、トランスサイレチン型心アミロイドーシス患者を対象としたアムヴトラの国際共同第Ⅲ相試験(HELIOS-B試験)においては、心不全の既往がある患者を組み入れ、NYHA心機能分類Ⅳ度の患者は除外されました。
適応とならない患者
-
2.
禁忌(次の患者には投与しないこと)
本剤の成分に対し重篤な過敏症の既往歴のある患者
アムヴトラの電子化された添付文書より
特定の背景を有する患者のうち留意すべき患者
-
9.
特定の背景を有する患者に関する注意(抜粋)
-
9.4
生殖能を有する者
妊娠可能な女性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊方法を行うよう指導すること。[9.5 参照]
-
9.5
妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。母体の血清中TTR又は血清中ビタミンA濃度の低下が胎児に及ぼす影響は不明である。妊娠ラットを用いた胚・胎児発生試験において、30mg/kgで母動物の体重及び/又は体重増加並びに摂餌量への有害作用、また、早産率及び着床後胚損失率の増加が認められた。10mg/kg以上で胎児体重に有害な減少がみられた。[9.4 参照]
-
9.6
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
-
アムヴトラの電子化された添付文書より
-
- 生殖能を有する者への投与
-
アムヴトラの投与により、血清中ビタミンA濃度の低下が引き起こされます。母体の血清中ビタミンA濃度の低下が胎児に及ぼす影響は不明であることから、患者の安全性を考慮して、注意喚起しています。
患者が妊娠を希望する場合は、アムヴトラの投与を中止し、血清中ビタミンA濃度をモニタリングしてください。アムヴトラの最終投与後12ヵ月以上にわたり血清中ビタミンA濃度の低下が持続する可能性があります。
-
- 妊婦への投与
-
妊婦へのアムヴトラの投与に関するデータはなく、母体の血清中TTR濃度または血清中ビタミンA濃度の低下が胎児に及ぼす影響は不明です。非臨床試験で、生殖毒性が認められたことから、患者の安全性を考慮して、注意喚起しています。
-
- 授乳婦への投与
-
アムヴトラのヒト母乳中への移行、授乳児に対する影響、および乳汁産生に対する影響に関するデータは得られていませんが、患者の安全性を考慮して、注意喚起しています。
その他の特定の背景を有する患者
-
9.
特定の背景を有する患者に関する注意(抜粋)
-
9.1
合併症・既往歴等のある患者
-
9.1.1
肝移植後の患者
肝移植後の患者を対象とした臨床試験は実施していない。
-
-
9.2
腎機能障害患者
重度の腎機能障害患者及び末期腎不全患者を対象とした臨床試験は実施していない。[16.6.1 参照]
-
9.3
肝機能障害患者
重度の肝機能障害患者を対象とした臨床試験は実施していない。[16.6.2 参照]
-
9.7
小児等
小児等を対象とした臨床試験は実施していない。
-
アムヴトラの電子化された添付文書より
-
- 肝移植後の患者への投与
-
肝移植後の患者を対象とした臨床試験は実施していないため、注意喚起しています。
-
- 腎機能障害患者への投与
-
アムヴトラの臨床試験において重度の腎機能障害患者および末期腎不全患者は除外されたため、注意喚起しています。
-
- 肝機能障害患者への投与
-
アムヴトラの臨床試験において重度の肝機能障害患者は除外されたため、注意喚起しています。
-
- 小児等への投与
-
トランスサイレチンアミロイドーシスは主に成人で発症するため、小児を対象とした臨床試験の実施は困難であり、アムヴトラの臨床試験において18歳未満の青年および小児に関する利用可能な成績は得られていないため、注意喚起しています。
