臨床成績
■トランスサイレチン型家族性アミロイドポリニューロパチー 国際共同第Ⅲ相試験(HELIOS-A試験)
試験概要
目的
トランスサイレチン型家族性アミロイドポリニューロパチー患者におけるアムヴトラの有効性および安全性などを評価する。
試験デザイン
第Ⅲ相、国際共同、無作為化、同時実薬対照および外部プラセボ対照、オープンラベル試験
対象
トランスサイレチン型家族性アミロイドポリニューロパチー成人患者164例(日本人7例を含む)
-
年齢18~85歳
-
TTR遺伝子変異を有し、トランスサイレチン型家族性アミロイドポリニューロパチーと診断された患者
-
NISが5点以上130点以下
-
PNDスコアがⅢB以下
-
NYHA心機能分類がクラスⅡ以下
-
KPS※スコアが60%以上
-
中等度または重度の肝機能障害、重度の腎機能障害(末期腎不全を含む)を有さない患者
- ※
-
Karnofsky Performance Status:機能状態の指標。スコアの範囲:0%(死亡)~100%(正常で臨床症状なし)の11段階で採点を行う。
方法
投与期と継続投与期の2パートからなる。
-
- 投与期(18ヵ月間)
-
初回投与前、患者をアムヴトラ群(ブトリシランとして25mgを3ヵ月に1回皮下投与)または実薬対照のオンパットロ群(パチシランとして0.3mg/kgを3週間に1回静脈内投与※1,2)に3:1の比で無作為化した[TTR遺伝子型(V30M型と非V30M型)およびベースラインのNIS(50点未満と50点以上)で層別化]。主要な有効性評価を初回投与前、投与9ヵ月(有効性の主要解析)および投与18ヵ月時点に実施した。なお、本試験に参加した患者は、1日推奨用量のビタミンAを投与することが指導された。
- ※1
-
患者の実際の体重に基づき投与量を決定し、体重100kg以上の患者に対しては最大推奨用量を30mgとした。
- ※2
-
すべての患者に前投薬として、コルチコステロイド(デキサメタゾンまたは同等薬)、アセトアミノフェン、H1拮抗薬(ジフェンヒドラミンまたは同等薬)およびH2拮抗薬(ラニチジンまたは同等薬)を投与した。
-
- 継続投与期(18ヵ月間)
-
投与期を完了した患者を1:1の比で無作為化し、ブトリシランとして25mgを3ヵ月に1回または50mgを6ヵ月に1回皮下投与した。安全性評価を年4回、有効性評価を9ヵ月に1回(投与27、36ヵ月時点)実施する。
-
- フォローアップ期間
-
すべての患者を最低3ヵ月間フォローアップする。フォローアップ期間中、アムヴトラを投与されたすべての患者は、血清中TTR濃度がベースラインの80%以上に回復するまで(治験薬最終投与から最長1年間)、または患者が臨床治療の一環として血清中TTR濃度低下レジメンを開始するまでのいずれか早い時点までに、年4回の安全性評価を受ける。
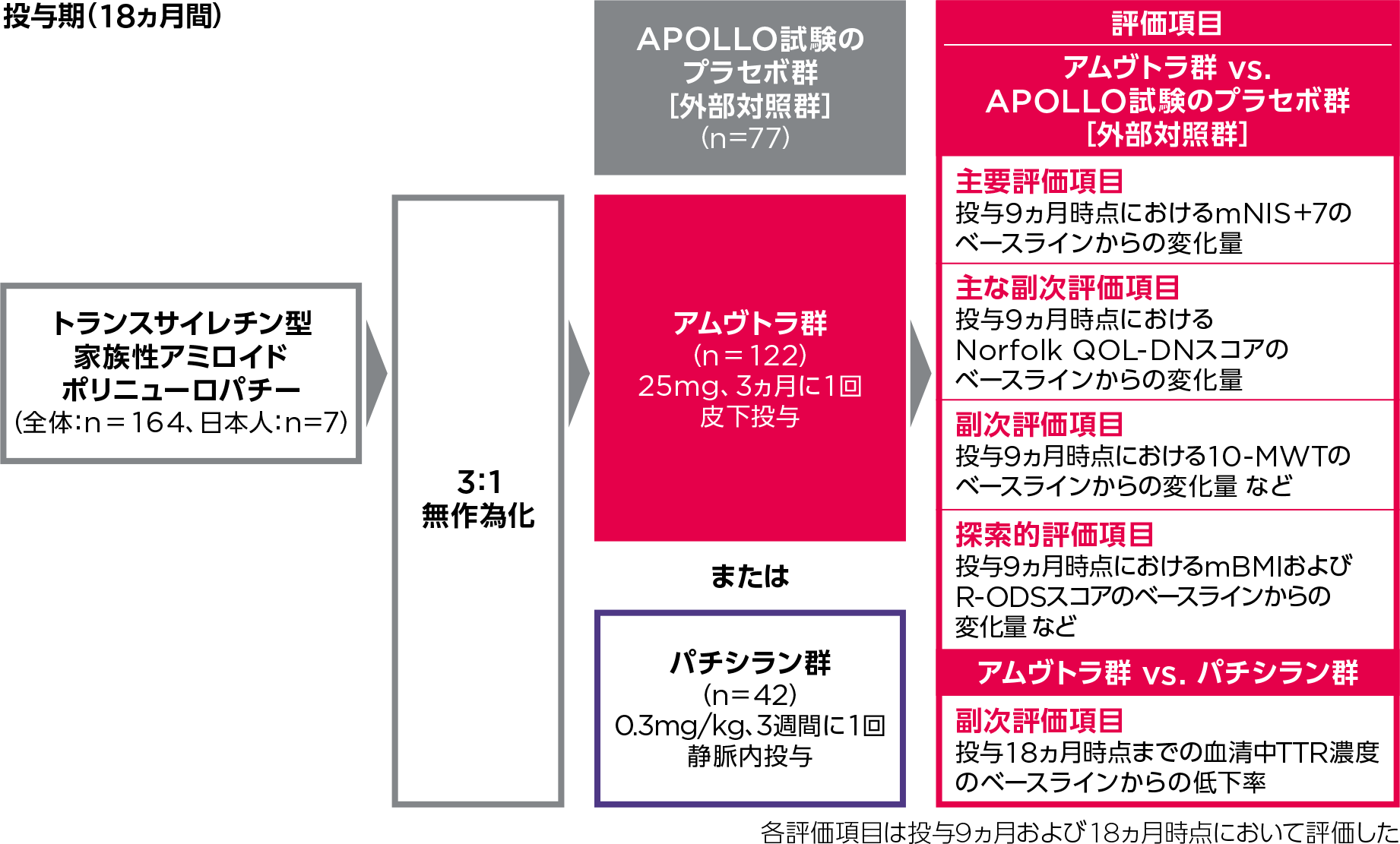
本試験では、アムヴトラの有効性の主要解析、大部分の副次解析および探索的解析の外部対照として、安全性解析の外部参照として、トランスサイレチン型家族性アミロイドポリニューロパチー患者を対象としたオンパットロの国際共同第Ⅲ相試験(APOLLO試験)のプラセボ群を用いた。
評価項目
- 主要評価項目
-
投与9ヵ月時点におけるmNIS+7のベースラインからの変化量(アムヴトラ群とAPOLLO試験のプラセボ群との差)
- 主な副次評価項目
-
投与9ヵ月時点におけるNorfolk QOL-DNスコアのベースラインからの変化量(アムヴトラ群とAPOLLO試験のプラセボ群との差)
- 副次評価項目
-
投与9ヵ月時点における10-MWTのベースラインからの変化量(アムヴトラ群とAPOLLO試験のプラセボ群との差)
投与18ヵ月時点における、以下の項目のベースラインからの変化量(アムヴトラ群とAPOLLO試験のプラセボ群との差)
-
mNIS+7
-
Norfolk QOL-DNスコア
-
10-MWT
-
mBMI
-
R-ODSスコア
投与18ヵ月時点までの血清中TTR濃度のベースラインからの低下率(アムヴトラ群とオンパットロ群との差)
-
- 探索的評価項目
-
投与9ヵ月時点における、以下の項目のベースラインからの変化量(アムヴトラ群とAPOLLO試験のプラセボ群との差)
-
mBMI
-
R-ODSスコア
以下の項目のベースラインからの変化量の推移
-
NT-proBNP濃度、心エコーパラメータ、トロポニンI濃度、トロポニンT濃度、NYHA心機能分類
-
NIS
-
EQ-5D-5LスコアおよびEQ-VASスコア
-
FAPステージおよびPNDスコア
投与18ヵ月時点における99mTcシンチグラフィによる心機能パラメータのベースラインからの変化量
血清中TTR濃度および血清中ビタミンA濃度の低下率の推移
など
-
- 安全性評価項目
-
有害事象の発現頻度
解析計画
有効性の解析および薬力学はmITT集団を対象とし、投与18ヵ月の血清中TTR濃度の解析は、TTR Per protocol(TTR PP)集団を対象とした。安全性の解析は、投与期においては安全性解析対象集団を対象とし、投与期+継続投与期においては全アムヴトラ投与解析対象集団を対象とした。
- 解析対象集団の定義
-
-
- mITT集団
-
無作為化され、投与量にかかわらず治験薬を投与されたすべての患者
-
- 心アミロイドーシス集団
-
mITT集団のうち、心臓へのアミロイド沈着が事前に確認されたすべての患者
(ベースライン時に左室壁の厚みが1.3cm以上で、大動脈弁疾患および高血圧の病歴がない患者)
-
- TTR PP集団
-
mITT集団のうち、ベースラインの血清中TTR濃度データおよび投与6ヵ月(24週)~18ヵ月(72週)の1時点以上でベースライン後の評価に適した血清中TTRトラフ濃度データを有するすべての患者
-
- 安全性解析対象集団
-
投与量にかかわらず、治験薬を投与されたすべての患者
-
- 全アムヴトラ投与解析対象集団
-
アムヴトラを投与されたすべての患者。投与期のアムヴトラ群の患者および継続投与期に移行してアムヴトラを投与されたオンパットロ群の患者を含む。
-
- PK解析対象集団
-
無作為化され、治験薬(計画された投与量)を1回以上投与され、投与後にPK評価用の血液検体が1回以上採取され、かつ評価可能なPKデータを有するすべての患者。実際の投与に基づき解析した。
-
- 解析方法
-
-
- 有効性
-
有効性は、血清中TTR濃度に関する評価項目を除き、アムヴトラ群と外部対照であるAPOLLO試験のプラセボ群の2つの治療群を対象とし、HELIOS-A試験のオンパットロ群については単純な記述統計量のみを示した。血清中TTR濃度についてはオンパットロ群と比較した。
主要評価項目および副次評価項目の解析は、評価項目の項で記載した順に階層検定し、両側0.05を有意水準とした比較が有意であった場合に次の階層の評価項目を正式に検定した。それ以外は、記述的に要約した。
各評価項目に使用した解析モデルは以下のとおりであった。
-
(1)
- 投与9ヵ月時点の解析
-
主な連続変数の有効性評価項目は、多重補完(MI)法を組み込んだ共分散分析(ANCOVA)モデルを用いた。
mNIS+7のベースラインからの変化量は、ベースライン値を連続共変量、投与群、TTR遺伝子型および発症時の年齢をカテゴリカル因子として解析した。
Norfolk QOL-DNスコア、10-MWT、mBMI、R-ODSスコア、NIS、EQ-5D-5LスコアおよびEQ-VASスコアのベースラインからの変化量は、カテゴリカル因子にベースラインのNISを追加して解析した。EQ-5D-5Lスコアは、各ドメイン内の順序カテゴリカル変数を来院毎に要約した。
NT-proBNP濃度のベースラインからの変化量は、カテゴリカル因子(投与群)および連続共変量(対数変換したベースライン値)を考慮し、ベースラインに対する投与9ヵ月時点の対数比を用いたANCOVA/MIモデルから最小二乗推定値を算出した。
-
(2)
- 投与18ヵ月時点の解析
-
主な連続変数の有効性評価項目は、Mixed-effect Model Repeated Measure(MMRM)法を用いた。
mNIS+7のベースラインからの変化量は、ベースライン値を連続共変量、投与群、来院(9ヵ月、18ヵ月)、TTR遺伝子型、発症時の年齢をカテゴリカル因子、投与群と来院を交互作用として解析した。
Norfolk QOL-DNスコア、10-MWT、mBMI、R-ODSスコア、NIS、EQ-5D-5LスコアおよびEQ-VASスコアのベースラインからの変化量は、カテゴリカル因子にベースラインのNISを追加した。
NT-proBNP濃度のベースラインからの変化量は、ベースライン値を連続共変量、投与群、来院をカテゴリカル因子、投与群と来院を交互作用として解析した。
-
(3)
- バイナリ分析
-
mNIS+7、Norfolk QOL-DNスコア、10-MWTにおいては、TTR遺伝子型を層別因子としたCochran-Mantel-Haenszel検定を用いて実施した。
-
(4)
- コンポーネント別・ドメイン別解析、サブグループ解析
-
mNIS+7、Norfolk QOL-DNスコアについては、各評価項目の解析に使用したモデルを用いてコンポーネント別、ドメイン別に解析を行った。また、ベースライン特性に基づくサブグループ解析を実施した。サブグループ解析には心アミロイドーシス集団の結果を含めた。
mNIS+7およびNorfolk QOL-DNスコアは、トランスサイレチン型家族性アミロイドポリニューロパチーに対する各地域での標準治療の開始後のデータを解析から除外した。また、mNIS+7、Norfolk QOL-DNスコア、10-MWT、mBMI、R-ODSスコア、NISおよび関連するコンポーネント別・ドメイン別スコアにおいて、COVID-19関連の重篤な有害事象の発現時以降のデータを解析から除外した。
-
-
- 薬力学
-
血清中TTR濃度のベースラインからの変化量は、各評価時点で投与群別に要約した。
投与18ヵ月時点の解析では、Hodges-Lehmann法を用いてアムヴトラ群とオンパットロ群の中央値の差の95%CIを推定した。最初に、層別した各層のデータをHodges-Lehmannの層内1標本中央値で調整した。血清中TTR濃度の低下率の中央値の差(アムヴトラ群-オンパットロ群)の95%CIの下限値が-10%を上回った場合を非劣性とした。
-
- 安全性
-
すべての安全性データは記述的に要約し、投与群別に示した。
-
- 注)
-
本試験は2019年2月14日に開始され(最初の患者の初回投与)、進行中である(2022年11月現在)。投与9ヵ月時の主要解析は中間データカットオフ日(2020年11月10日時点)までのデータを、投与18ヵ月時の有効性および安全性解析は中間データカットオフ日(2021年8月26日時点)までのデータを用いて行った。
-
6.
用法及び用量
通常、成人にはブトリシランとして25mgを3ヵ月に1回皮下投与する。
アムヴトラの電子化された添付文書より
社内資料(承認時評価資料):トランスサイレチン型家族性アミロイドポリニューロパチー患者を対象とした国際共同第Ⅲ相試験(HELIOS-A試験)
Adams D, Tournev IL, Taylor MS, et al. Amyloid. 2022(epub).(本試験はAlnylam Pharmaceuticalsの支援により実施された)
