臨床成績
■トランスサイレチン型心アミロイドーシス(野生型及び変異型) 国際共同第Ⅲ相試験(HELIOS-B試験)
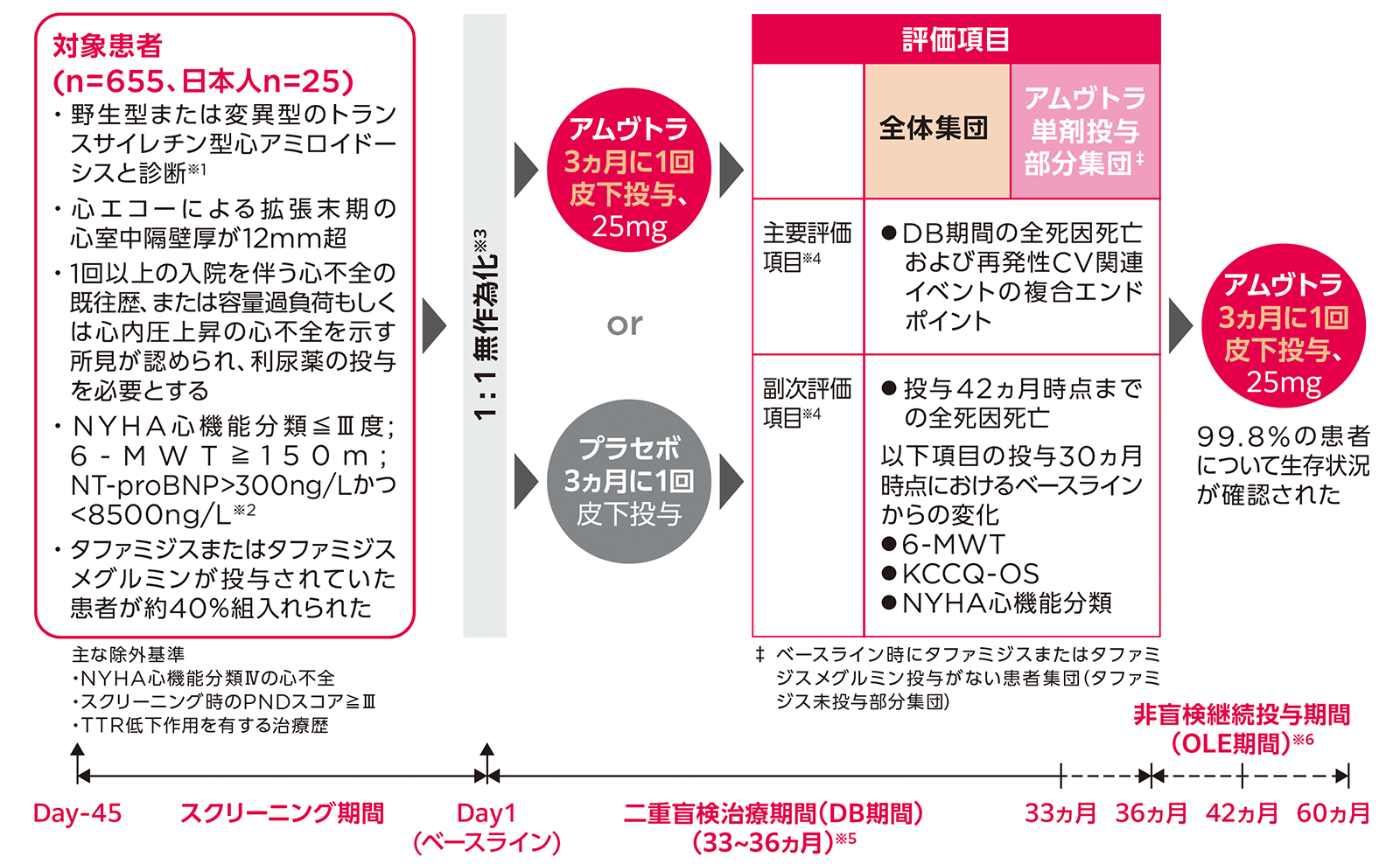
試験概要
目的
野生型または変異型のトランスサイレチン型心アミロイドーシス患者におけるアムヴトラの有効性および安全性を評価する。
試験デザイン
第Ⅲ相、国際共同、無作為化、二重盲検(DB)、プラセボ対照試験
対象
野生型または変異型のトランスサイレチン型心アミロイドーシス患者655例(日本人25例を含む)
方法
DB治療期間(DB期間)と非盲検継続投与期間(OLE期間)の2パートからなる。
- DB期間(最長36ヵ月):患者をアムヴトラ群(ブトリシランとして25mgを3ヵ月に1回皮下投与)またはプラセボ群に1:1の比で無作為化した。なお、患者には1日推奨用量のビタミンAを投与することが指導された。
- OLE期間(最長24ヵ月):DB期を完了したすべての患者にブトリシランとして25mgを3ヵ月に1回皮下投与した。
- ※1
-
以下のいずれかの検査および遺伝子検査により診断され、かつ血清および尿蛋白電気泳動、ならびに血清遊離軽鎖に基づきALアミロイドーシスが否定されている※。
①野生型の患者では、免疫組織化学染色法または質量分析法により心臓組織にTTRアミロイド沈着が認められる。変異型の患者ではコンゴーレッド染色法により心臓組織または非心臓組織にアミロイド沈着が認められる。
②99mTcシンチグラフィ(DPD-Tc、PYP-TcまたはHMDP)により心臓に陽性像が確認される。- ※
- ALアミロイドーシスが否定されなかった場合、免疫組織化学染色法または質量分析法により心臓組織または非心臓組織にTTRアミロイド沈着が認められることが必要とされた。なお、野生型の患者では、非心臓組織でのみTTRアミロイド沈着が認められた場合、99mTcシンチグラフィ(DPD-Tc、PYP-TcまたはHMDP)により心臓に陽性像が確認されることも必要とされた。
- ※2
-
永続性または持続性心房細動の患者の場合はNT-proBNP>600ng/L かつ <8500ng/L
- ※3
-
層別因子:ベースライン時のタファミジス使用の有無、ATTR-CMの病型(遺伝性または野生型)、NYHA心機能分類および年齢(Ⅰ度/Ⅱ度かつ75歳未満またはそれ以外)
- ※4
-
全体集団とアムヴトラ単剤投与部分集団で、別々のエンドポイントとして評価した。
- ※5
-
DB期間は36ヵ月目の通院完了後、または最後の患者が無作為化されてから30ヵ月後のいずれか早い方で終了とした。そのため、DB期間の患者の最終通院日はスクリーニング後の30ヵ月~36ヵ月までの幅があり、OLE期間の最初の投与は33ヵ月目または36ヵ月目であった。
- ※6
-
OLE期間の終了後(OLE期間まで継続しない患者の場合はDB期間の終了後、本剤を早期に中止した患者の場合は本剤の最終投与後)、フォローアップ期間が開始された。妊娠可能な女性の場合、フォローアップ期間は本剤の最終投与から最大18ヵ月であった。
評価項目
- <主要評価項目>(いずれも検証的評価項目)
-
-
DB期間の全体集団における全死因死亡および再発性CV関連イベントの複合エンドポイント
-
DB期間のアムヴトラ単剤投与部分集団※における全死因死亡および再発性CV関連イベントの複合エンドポイント
-
- 副次評価項目
-
全体集団およびアムヴトラ単剤投与部分集団※における以下の項目
-
投与42ヵ月時点までの全死因死亡
-
投与30ヵ月時点における6-MWTのベースラインからの変化量
-
投与30ヵ月時点におけるKCCQ-OSのベースラインからの変化量
-
投与30ヵ月時点におけるNYHA心機能分類のベースラインからの変化
-
- 探索的評価項目
-
全体集団およびアムヴトラ単剤投与部分集団※(サブグループ解析)における以下のパラメータについてのベースラインからの変化量
-
NT-proBNP濃度
-
トロポニンⅠ濃度
-
左室壁厚(心エコー検査による)
-
長軸方向左室グローバルストレイン(心エコー検査による) など
-
- 安全性評価項目
-
有害事象の発現頻度、MedDRA標準検索式(SMQ)の薬物関連肝障害に対応する有害事象
- 薬力学的評価項目
-
血清中TTR濃度のベースラインからの変化量 など
- 解析対象集団の定義
-
-
最大の解析対象集団(全体集団、FAS): 無作為化され、用量を問わず治験薬を投与されたすべての患者
-
アムヴトラ単剤投与部分集団FAS (mono-FAS):FASのうち、ベースライン時にタファミジスまたはタファミジスメグルミン投与を受けていなかったすべての患者
-
PD解析対象集団:治験薬の全量投与を1回以上受け、血清中TTR濃度の検討のためのベースラインおよび投与後に1つ以上の評価可能検体が得られたすべての患者
-
安全性解析対象集団:用量を問わず治験薬が投与されたすべての患者
(プラセボ群に無作為化されたが、DB期間中に用量を問わずアムヴトラの投与を受けた患者は、アムヴトラ群に分類)
-
- ※
-
ベースライン時にタファミジスまたはタファミジスメグルミン投与がない患者集団(タファミジス未投与部分集団)
解析計画
-
- 有効性
-
有効性は、全体集団およびアムヴトラ単剤投与部分集団※を用いて解析した。日本人集団については、治験計画書および統計解析計画書に記載がないが、審査において評価されたため記載する。また、ベースライン時の特性[タファミジス使用(あり、なし)、年齢(75歳未満、75歳以上)、ATTR-CMの病型(野生型、変異型)、NYHA心機能分類(Ⅰ/Ⅱ度、Ⅲ度)、NT-proBNP濃度(2000ng/L以下、2000ng/L超)]に基づくサブグループ解析を実施した。
各評価項目に使用した解析モデルは以下のとおりであった。
-
- 複合評価項目
-
投与群別の平均累積関数プロットを作成した。
-
- 経時的評価項目
-
投与群別の最小二乗(LS)平均(±平均値の標準誤差[SE])の経時的推移をプロットした。
-
- イベント発生までの期間
-
投与群別のKaplan-Meierプロットを作成した。
-
(1)
- 主要評価項目
-
主要評価項目は、投与群、ATTR-CMの病型(野生型、変異型)、NYHA心機能分類(Ⅰ/Ⅱ度、Ⅲ度)、年齢(75歳未満、75歳以上)、投与群および対数変換したベースラインのNT-proBNPを共変量としたロバスト分散推定量を用いた修正Andersen-Gillモデルを使用して解析した。全体集団ではベースライン時のタファミジス使用の有無により層別化したモデルを使用した。アムヴトラ群とプラセボ群における群間差(ハザード比:HR)は、点推定値、95%信頼区間(CI)、およびp値を算出した。主要解析にはDB期間に発生したイベントが含まれ、DB期間終了時の診察時、試験への同意撤回時、または追跡調査不能時のいずれか早い時点で打ち切りとした。心臓移植および/または左室補助装置の植込みを受けた患者は死亡として扱った。
- ※
-
ベースライン時にタファミジスまたはタファミジスメグルミン投与がない患者集団(タファミジス未投与部分集団)
-
(2)
- 副次評価項目
-
全死因死亡は、推定精度を向上させて投与群間差を検出する検出力を高めるために、DB期間に加えてOLE期間の初回投与後6ヵ月以内に収集された生存データを含めた投与42ヵ月時点のデータを使用してログランク検定により解析した。HRは、ATTR-CMの病型、NYHA心機能分類、および年齢によって調整されたCox比例ハザードモデルから推定した。全体集団ではベースライン時のタファミジス使用の有無により層別化したモデルを使用した。6-MWT、KCCQ-OSのベースラインからの変化量は投与30ヵ月時点の最小二乗(LS)平均の差により比較した。各ベースライン値、治療、来院、治療と来院の相互作用、ATTR-CMの病型、年齢、ベースライン時のタファミジスの使用の有無(全体集団のみ)、治療とベースライン時のタファミジスの使用の有無の相互作用(全体集団のみ)を固定効果項に含むMMRM法を使用して解析した。NYHA心機能分類のベースラインからの変化量は投与30ヵ月時点にNYHA心機能分類が安定または改善した患者の割合により比較した。データはRubinのルールに従った多重補完により補完され、ベースラインのNT-proBNP濃度、ベースライン時のタファミジスの使用の有無(全体集団のみ)で層別化されたCMH検定を使用して解析した。
-
(3)
- 探索的評価項目
-
NT-proBNP濃度、トロポニンⅠ濃度、左室壁厚、長軸方向左室グローバルストレインはいずれも、6-MWT/KCCQ-OSと同様のMMRM法に基づき解析を行った。ただし、NT-proBNP濃度、トロポニンⅠ濃度は対数変換を行った値を使用した。
-
-
- 薬力学
-
各評価時点で、血清中TTR濃度および血清中ビタミンA濃度の測定を行い、測定値、ベースラインからの変化量および変化率を投与群別に要約した。また、血清中TTR濃度について、サブグループ解析(年齢、性別、人種、ATTR-CMの病型、ベースライン時のタファミジスの使用の有無、NYHA心機能分類、体重、ADAの状態)を行った。
-
- 安全性
-
安全性データは、OLE期間に入った患者の場合はアムヴトラの初回投与日からOLE期間の最初の投与日まで、DB期間に治療を中止または完了した患者の場合はアムヴトラの最終投与後84日までのデータに基づいて要約した。
本試験では、主要解析と最終解析が計画されていた。有効性の主要解析はFASを対象とし、無作為化割り付けされた投与群に基づき解析した。PDはPD解析対象集団を対象とし、初回の投与に基づき解析した。安全性は受けた治療に基づき解析した。
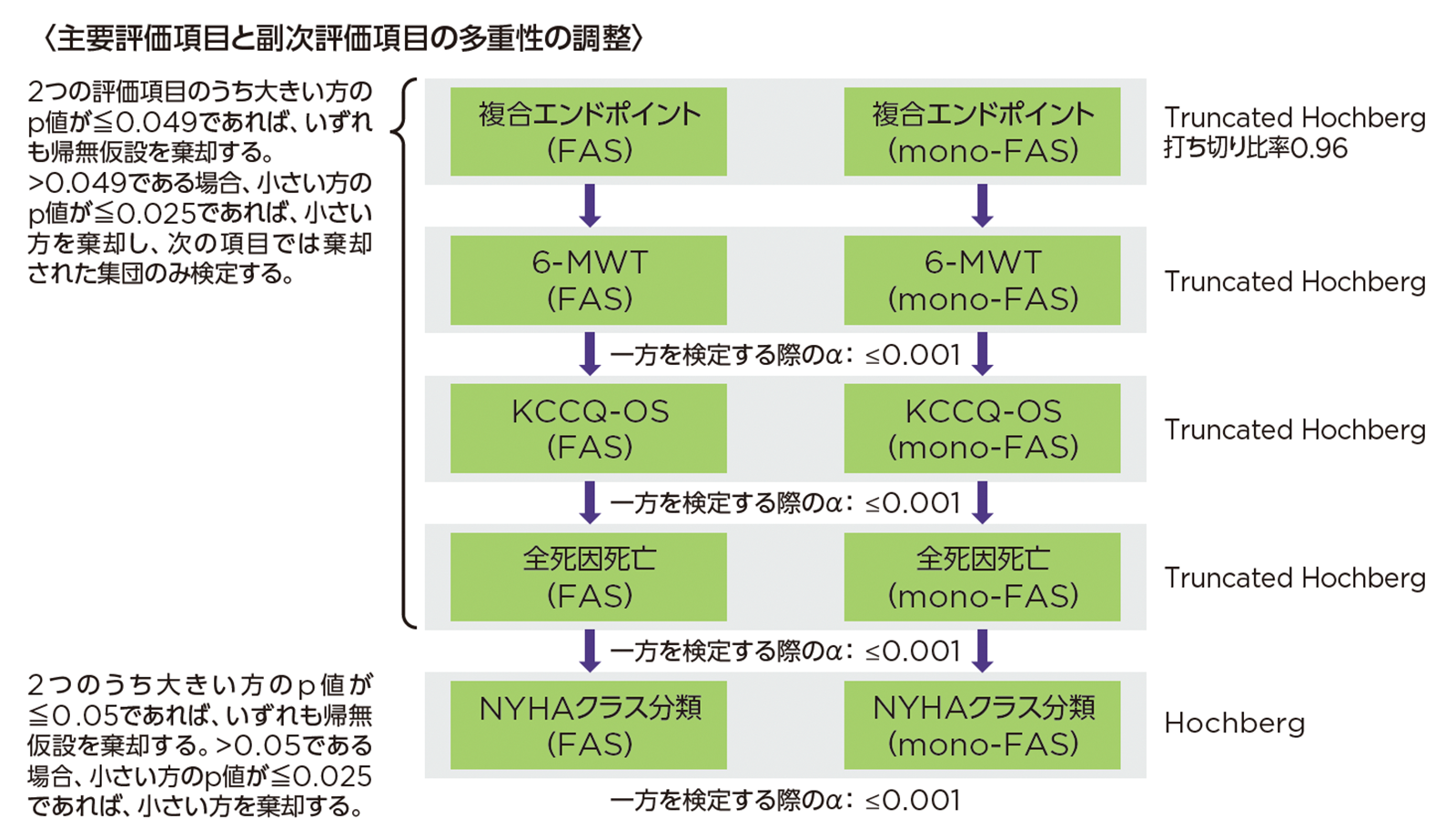
主要評価項目と副次評価項目(6-MWT、KCCQ-OS、全死因死亡、NYHA心機能分類)の多重性については、固定順序法を用いて、試験全体の有意水準を両側0.05になるように厳密に制御した。
主要評価項目と3つの副次評価項目は、0.96の打ち切り比率によるtruncated Hochberg検定1)を用いて検定し、最後の副次評価項目ファミリーは通常のHochberg検定を用いて検定した。
主要評価項目は有意水準を0.05として群間比較を行った。2つの主要評価項目が統計的に有意であった場合、6-MWTから順番に後続の検定を実施した。2つの主要評価項目のうち大きい方のp値が0.049超、小さい方のp値が0.025以下であった場合は、主要評価項目の検定で棄却された集団で6-MWTの検定を行った(有意水準0.001)。大きい方のp値が0.049超、小さい方のp値が0.025超であった場合、検定を中止した。統計的有意差が認められなかった場合、後続の検定は実行して結果を要約するが、統計的有意性は推定しなかった。また、その他の副次評価項目および探索的評価項目について、多重性の調整は行わない。- 1)
- Dmitrienko A, Tamhane AC. Biom J. 2013; 55(3):402-419.
本試験は2019年11月26日に開始された。データカットオフ日時点で得られている有効性に関する主要解析データおよび全ての安全性データ(OLE期のデータを含む)に基づいている。
-
6.
用法及び用量
通常、成人にはブトリシランとして25mgを3ヵ月に1回皮下投与する。
アムヴトラの電子化された添付文書より
社内資料:トランスサイレチン型心アミロイドーシス患者を対象とした国際共同第Ⅲ相試験(HELIOS-B 試験)
Fontana M, Berk JL, Gillmore JD, et al. N Engl J Med. 2025: 392(1):33-44.( 本試験はAlnylam Pharmaceuticalsの支援により実施された)
